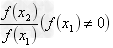声明:百科词条人人可编辑,词条创建和修改均免费,绝不存在官方及代理商付费代编,请勿上当受骗。详情
,式量47.998,氧元素的一种同素异形体。有鱼腥气味的淡蓝色气体。臭氧有强氧化性,是比氧气更强的氧化剂,可在较低温度下发生氧化反应,如能将银氧化成过氧化银,将硫化铅氧化成硫酸铅、跟碘化钾反应生成碘。松节油、煤气等在臭氧中能自燃。有水存在时臭氧是一种强力漂白剂。跟不饱和有机化合物在低温下也容易生成臭氧化物。用作强氧化剂,漂白剂、皮毛脱臭剂、空气净化剂,消毒杀菌剂,饮用水的消毒脱臭。在化工生产中可用臭氧代替许多催化氧化或高温氧化,简化生产工艺并提高生产率。液态臭氧还可用作火箭燃料的氧化剂。存在于大气中,靠近地球表面浓度为0.001~0.03ppm,是由大气中氧气吸收了太阳的波长小于185nm紫外线后生成的,此臭氧层可吸收太阳光中对人体有害的短波(30nm以下)光线,防止这种短波光线射到地面,使人类免受紫外线]
,又称三原子氧、超氧,因其类似鱼腥味的臭味而得名,在常温下可以自行还原为氧气。比重比氧大,易溶于水,易分解。由于臭氧是由氧分子携带一个氧原子组成,决定了它只是一种暂存状态,携带的氧原子除氧化用掉外,剩余的又组合为氧气进入稳定状态,所以臭氧没有二次污染。
(液,-185.4℃),沸点-111.9℃,固态臭氧是蓝黑色,熔点-192.7℃。分子呈V形,不稳定。常温下分解较慢,在164℃以上或有催化剂存在时或用波长为25nm左右的紫外线照射臭氧时加速分解成氧气。
a在常温常压下臭氧为气体,其临界温度-12.1℃,临界压力5.31MPa。气态时为浅蓝色,液化后为深蓝色,固态时为紫黑色。气体难溶于水,不溶于液氧,但可溶于液氮及碱液。液态臭氧在常温下缓慢分解,高温下迅速分解,产生氧气,受撞击或摩擦时可发生爆炸。
臭氧在水溶液中的分解速度比其在气相中的分解速度快。臭氧在水中分解半衰期与温度及pH值有关。随着温度升高,分解速度加快。温度超过100℃时,分解剧烈;温度达到270℃时,可立即转化为氧气。pH值越高,分解就越快。在常温常态常压的空气中分解,半衰期约为15~30min。
臭氧可使大多数有机色素褪色。可缓慢侵蚀橡胶、软木,使有机不饱和化合物被氧化。常用于:饮料的消毒和杀菌,空气净化、漂白、水处理及饮水消毒、粮仓杀灭霉菌及虫卵;与有机不饱和物反应,可生成臭氧化物,这些臭氧化物在水的存在下可分解,原来的不饱和键开链,生成醛、酮羧酸等。由于产生臭氧分解,故可用作合成手段及确定有机物结构。
臭氧具有极强的氧化性和杀菌性能,是自然界最强的氧化剂之一,在水中氧化还原电位仅次于氟而居第二位。同时,臭氧反应后的产物是氧气,所以臭氧是高效的无二次污染的氧化剂。作为强氧化剂,其特点如下
a:①可用作选择氧化、主产品得率高;③氧化温度低,在常压下氧化能力也较强,且对敏感物质的氧化有利;③反应速度快,可定量氧化;④使用与制造方便。
臭氧的应用基础是其极强的氧化能力与杀菌能力。臭氧的应用按其作用分类,可分为:杀菌、脱色、脱臭、脱味及氧化分解。按其应用领域分,主要应用在以下领域:水处理;食品加工、存储、保鲜;家用电器;医疗卫生;化学氧化。
臭氧分析方法主要有光谱分析和电化学分析。常用检测方法主要为碘量法、靛蓝二磺酸钠分光光度法、紫外吸收法和化学发光法。实验室常用的是碘量法。将臭氧通入碘化钾溶液中,可使碘游离出来,这一反应可用作臭氧的定量分析。
,以淀粉为指示剂,用硫代硫酸钠滴定,也可用淀粉试剂显色后,根据颜色深浅,在550nm处比色测定。
早在1785年,德国物理学家冯·马鲁姆用大功率电机进行实验时发现,当空气流过一串火花时,会产生一种特殊气味,但并未深究。此后,舒贝因于1840年也发现在电解和电火花放电实验过程中有一种独特气味,并断定它是由一种新气体产生的,从而宣告了臭氧的发现。